Os cientistas identificaram uma ligação entre a proteína de transporte de íons ZIP7 e o sistema de degradação de proteínas da célula, o proteassoma. Esta descoberta fornece um caminho promissor para o tratamento de doenças causadas pelo mau enrolamento de proteínas, como Alzheimer e Parkinson.
Os investigadores identificaram um alvo de terapia genética que poderia potencialmente retardar o desenvolvimento e a progressão de doenças degenerativas.
As proteínas servem como blocos de construção, receptores, processadores, mensageiros e catalisadores nos organismos. A estrutura de uma proteína é crítica para sua função. Proteínas mal dobradas são incapazes de realizar suas tarefas e também podem se acumular, levando a uma variedade de doenças degenerativas incuráveis, como AlzheimerParkinson e retinite pigmentosa.
Em um novo artigo publicado pela Célula de Desenvolvimento, pesquisadores da Universidade da Califórnia, em Santa Bárbara, revelam uma nova conexão entre a proteína de transporte de íons ZIP7 e o proteassoma da célula, que degrada proteínas mal dobradas. Esta ligação oferece um alvo promissor para o tratamento de uma variedade de doenças degenerativas causadas pelo enrolamento incorreto de proteínas.

Esta é uma história sobre proteínas, como elas funcionam mal e o que as células fazem para evitar isso. Crédito: Matt Perko, UC Santa Bárbara
ZIP7 e mobilidade celular
Durante 35 anos, o laboratório de Montell estudou o movimento das células nos ovários das moscas-das-frutas. “Ao estudar a biologia celular básica em ovários de moscas-das-frutas, descobrimos uma maneira de prevenir a neurodegeneração e acreditamos que isso tem aplicações potenciais no tratamento de algumas doenças humanas”, disse a autora sênior Denise Montell, professora Duggan e ilustre professora do Departamento. de Biologia Molecular, Celular e do Desenvolvimento. “O movimento celular está subjacente ao desenvolvimento embrionário, impulsiona a cicatrização de feridas e contribui para a metástase tumoral”, explicou ela. “Portanto, é um comportamento celular realmente fundamental que nos importamos em compreender profundamente.”
Em trabalhos anteriores, a equipe de Monell descobriu uma mutação em um gene chamado ZIP7, que codifica uma proteína de mesmo nome, que prejudicava a mobilidade celular.
A proteína ZIP7 transporta íons de zinco dentro de uma célula. Esses íons são extremamente raros no citoplasma, mas abundantes em proteínas, onde frequentemente fazem parte da arquitetura e catalisam reações químicas. “O ZIP7 é conservado na evolução das plantas às leveduras, das moscas aos humanos”, disse Montell. “Portanto, está fazendo algo realmente fundamental, porque já existe há muito tempo.”
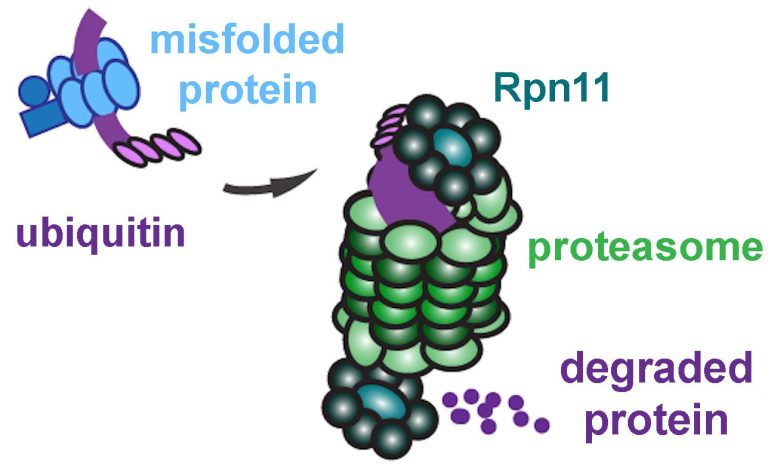
Os proteassomas trituram proteínas mal dobradas marcadas para reciclagem, mas a enzima Rpn11 deve primeiro remover essa etiqueta para que a proteína possa caber. Crédito: Xiaoran Guo e Morgan Mutch et al.
ZIP7 também é o único transportador de zinco encontrado no retículo endoplasmático, uma estrutura membranosa onde uma célula produz proteínas destinadas à membrana externa da célula ou à secreção para fora da célula. Cerca de um terço das nossas proteínas são produzidas aqui.
Se ZIP7 é o nosso protagonista, então as proteínas mal dobradas e seu descarte são o tema do estudo. Para proteínas, a função segue a forma. Não basta ter os ingredientes certos, uma proteína deve dobrar-se corretamente para funcionar corretamente. Proteínas mal dobradas são responsáveis por uma série de doenças e distúrbios.
Mas as proteínas, por vezes, dobram-se mal, mesmo numa célula saudável. Felizmente, as células possuem um sistema de controle de qualidade para lidar com esta eventualidade. Se o erro for pequeno, a célula pode tentar dobrá-la novamente. Caso contrário, irá marcar a molécula mal dobrada com uma pequena proteína chamada ubiquitina e enviá-la para fora do retículo endoplasmático (RE) para reciclagem.
Esperando no citoplasma estão estruturas chamadas proteassomas, os “trilhos de lixo” da célula. “Ele literalmente mastiga a proteína em pequenos pedaços que podem ser reciclados”, disse Montell.
“Mas se o triturador de lixo ficar sobrecarregado – alguém coloca muitas cascas de batata lá – então a célula sofre estresse no RE.” Isto desencadeia uma resposta que retarda a síntese proteica (pausa a preparação da batata) e produz mais proteassomas para que o sistema possa eliminar o acúmulo de resíduos. Se tudo isso falhar, a célula sofre morte programada.
Detalhes e descobertas do estudo
Co-autor principal Xiaoran Guo, ex-Ph.D. de Montell. estudante, viu que a perda de ZIP7 causou estresse no RE no ovário da mosca da fruta. Então ela decidiu determinar se esse estresse era a razão pela qual as células perdiam a mobilidade. De facto, a indução do stress do RE com uma proteína mal dobrada diferente também prejudicou a migração celular.
Quando Guo superexpressou ZIP7 nessas células, o acúmulo de proteínas mal dobradas desapareceu, o estresse do RE desapareceu e as células recuperaram sua mobilidade. “Fiquei tão surpreso que tive que me questionar se tinha feito tudo corretamente”, disse Guo. “Se isso fosse real, apenas o ZIP7 por si só deveria ser muito potente na resolução do estresse do pronto-socorro.”
Além do mais, a proteína mal dobrada que ela usou, chamada rodopsina, não contém zinco em sua estrutura. Isso levou Guo a suspeitar que o ZIP7 deveria estar envolvido em algum lugar no caminho de degradação. O coautor principal e colega de doutorado, Morgan Mutch, usou um medicamento para impedir que o proteassoma degradasse a rodopsina mal dobrada e observou que isso anulava o efeito benéfico do ZIP7. Ela concluiu que o ZIP7 deve estar agindo em algum lugar antes que o proteassoma coma a proteína mal dobrada.
Os autores criaram quatro modificados ZIP7 genes: duas mutações interromperam a capacidade da proteína de transportar zinco, enquanto as outras duas deixaram isso inalterado. Eles descobriram que o transporte de zinco era fundamental na redução do estresse do RE.
Neste ponto, um novo personagem entra na nossa história: a enzima Rpn11, que faz parte do proteassoma. Assim como tentar colocar uma grande cabeça de brócolis no lixo, proteínas mal dobradas com marcadores de ubiquitina não cabem no proteassoma. O Rpn11 corta essas tags, permitindo que a proteína mal dobrada deslize para o núcleo do proteassoma para desmontagem. O zinco é essencial para o Rpn11 catalisar a remoção da ubiquitina.
“Fiquei muito surpreso, e depois animado, quando vi que o aumento da expressão de ZIP7 impediu quase completamente o acúmulo dessas proteínas marcadas com ubiquitina”, disse Mutch. “Esperávamos o resultado oposto.”
Mutch determinou que o ZIP7 era fundamental no fornecimento de zinco ao Rpn11, permitindo-lhe cortar as etiquetas que rotulam as proteínas defeituosas para que se ajustassem à estrutura que realmente as decompõe. O bloqueio da enzima Rpn11 confirmou esta hipótese.
“Essa sensação de quando você descobre algo novo, algo que ninguém descobriu antes, é a melhor sensação para um cientista”, acrescentou Mutch.
Implicações terapêuticas
Os resultados sugerem que a superexpressão ZIP7 poderia constituir a base para o tratamento de uma variedade de doenças. Por exemplo, a rodopsina mal dobrada causa retinite pigmentosa, uma doença congênita que causa cegueira e atualmente é intratável. Os cientistas já têm uma estirpe de moscas da fruta com a mutação que causa uma doença semelhante, por isso a equipa exagerou na expressão. ZIP7 gene nessas moscas para ver o que aconteceria.
“Descobrimos que previne a degeneração da retina e a cegueira”, disse Montell. Cada uma das moscas com rodopsina mutante geralmente desenvolve retinite pigmentosa, mas 65% daquelas com rodopsina hiperativa ZIP7 olhos formados que respondem normalmente à luz.
O laboratório de Montell está agora colaborando com o professor Dennis Clegg, também da UC Santa Bárbara, para investigar mais detalhadamente o efeito do ZIP7 em organoides da retina humana, culturas de tecidos que apresentam uma mutação que causa a retinite pigmentosa. Este projeto foi originalmente financiado pelo Instituto Nacional de Ciências Médicas Gerais. Durante os próximos três anos, será apoiado por uma doação de 900.000 dólares da Foundation Fighting Blindness para que Montell, Clegg e os seus colegas possam testar a hipótese de que a terapia genética ZIP7 prevenirá a cegueira em pacientes com retinite pigmentosa.
Além disso, a capacidade do proteassoma diminui à medida que envelhecemos, contribuindo para muitos sinais clássicos de envelhecimento e aumentando a probabilidade de doenças degenerativas relacionadas com a idade. Direcionamento de terapias ZIP7 poderia potencialmente retardar o desenvolvimento ou progressão dessas doenças também. Eles já produziram resultados promissores, prolongando a vida útil das moscas-das-frutas.
“Este é um exemplo de pesquisa fundamental movida pela curiosidade”, disse Montell. “Você só está estudando algo porque é legal, e segue os dados e acaba descobrindo algo que nunca se propôs a estudar, possivelmente até uma cura para múltiplas doenças.”
Referência: “O Zn2+ transportador ZIP7 aumenta a degradação de proteínas associadas ao retículo endoplasmático e previne a neurodegeneração em Drosófila”por Xiaoran Guo, Morgan Mutch, Alba Yurani Torres, Maddalena Nano, Nishi Rauth, Jacob Harwood, Drew McDonald, Zijing Chen, Craig Montell, Wei Dai e Denise J. Montell, 25 de abril, Célula de Desenvolvimento.
DOI: 10.1016/j.devcel.2024.04.003
