Um avanço na agricultura celular, que permite às células bovinas produzirem os seus próprios factores de crescimento, promete reduções significativas de custos na produção de carne cultivada. Este avanço poderá levar a alternativas de carne acessíveis e sustentáveis nos supermercados, com pesquisas em andamento focadas na otimização para uso comercial e na aprovação regulatória.
As células musculares bovinas foram projetadas para gerar seus próprios sinais de crescimento, eliminando a necessidade de componentes caros no processo de produção.
A agricultura celular – a produção de carne a partir de células cultivadas em biorreatores em vez de colhidas de animais de criação – está a dar saltos tecnológicos que a tornam uma opção mais viável para a indústria alimentar. Um desses saltos foi dado agora no Centro de Agricultura Celular da Universidade Tufts (TUCCA), liderado por David Kaplan, Professor de Engenharia da Família Stern, no qual os pesquisadores criaram células musculares bovinas (carne bovina) que produzem seus próprios fatores de crescimento, um passo que pode reduzir significativamente os custos de produção.
Os factores de crescimento, quer sejam utilizados em experiências laboratoriais ou para carne cultivada, ligam-se a receptores na superfície celular e fornecem um sinal para as células crescerem e se diferenciarem em células maduras de diferentes tipos. Neste estudo publicado na revista Relatórios de células Sustentabilidadeos pesquisadores modificaram células-tronco para produzir seu próprio fator de crescimento de fibroblastos (FGF), que desencadeia o crescimento de células musculares esqueléticas – o tipo que se encontra em um bife ou hambúrguer.
“O FGF não é exatamente um nutriente”, disse Andrew Stout, então pesquisador principal do projeto e agora Diretor de Ciência do Laboratório de Comercialização de Agricultura Celular Tufts. “É mais como uma instrução para as células se comportarem de determinada maneira. O que fizemos foi projetar células-tronco musculares bovinas para produzir esses fatores de crescimento e ativar as próprias vias de sinalização”.
Redução de custos e progresso da pesquisa
Até agora, os fatores de crescimento tinham que ser adicionados ao líquido ou meio circundante. Feitos a partir de proteína recombinante e vendidos por fornecedores industriais, os fatores de crescimento contribuem para a maior parte do custo de produção da carne cultivada (até ou acima de 90%). Como os fatores de crescimento não duram muito nos meios de cultura celular, eles também precisam ser repostos a cada poucos dias. Isso limita a capacidade de fornecer um produto acessível aos consumidores. Retirar esse ingrediente da mídia de crescimento leva a uma enorme economia de custos.

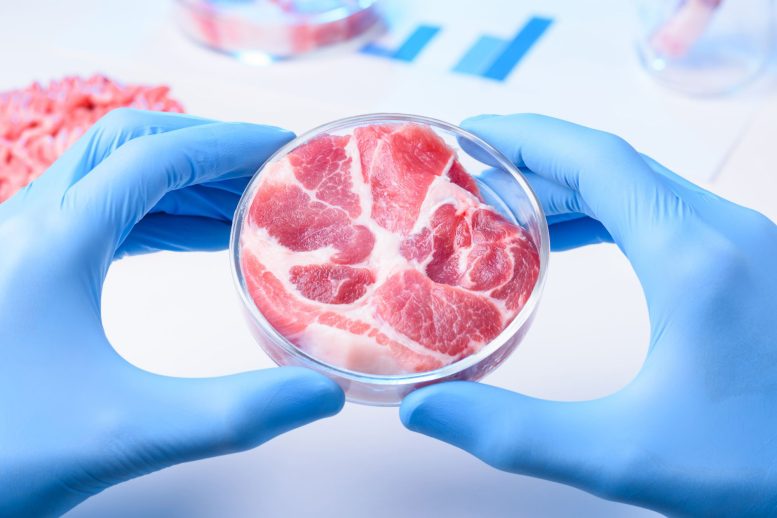
As células musculares bovinas cultivadas para produção de carne produzem seus próprios fatores de crescimento, removendo um ingrediente caro do meio líquido de crescimento. Crédito: Alonso Nichols, Universidade Tufts
Stout está liderando vários projetos de pesquisa no Laboratório de Comercialização de Agricultura Celular da Tufts University – um espaço de incubadora de tecnologia criado para receber inovações na universidade e desenvolvê-las até o ponto em que possam ser aplicadas em escala industrial em um ambiente comercial.
“Embora tenhamos reduzido significativamente o custo da mídia, ainda há alguma otimização que precisa ser feita para torná-la pronta para a indústria”, disse Stout. “Vimos um crescimento mais lento com as células projetadas, mas acho que podemos superar isso.” As estratégias podem incluir a alteração do nível e do tempo de expressão do FGF na célula ou a alteração de outras vias de crescimento celular. “Nesta estratégia, não estamos adicionando genes estranhos à célula, apenas editando e expressando genes que já estão lá” para ver se conseguem melhorar o crescimento das células musculares para a produção de carne. Essa abordagem também poderia levar a uma aprovação regulatória mais simples do produto alimentar final, uma vez que a regulamentação é mais rigorosa para a adição de genes estranhos do que para a edição de genes nativos.
Direções e implicações futuras
A estratégia funcionará para outros tipos de carne, como frango, porco ou peixe? Stout pensa assim. “Todas as células musculares e muitos outros tipos de células normalmente dependem do FGF para crescer”, disse Stout. Ele prevê que a abordagem será aplicada a outras carnes, embora possa haver variabilidade para que os melhores fatores de crescimento se expressem em diferentes espécies.
“O trabalho continua na TUCCA e em outros lugares para melhorar a tecnologia da carne cultivada”, disse Kaplan, “incluindo a exploração de maneiras de reduzir o custo dos nutrientes nos meios de crescimento e melhorar a textura, o sabor e o conteúdo nutricional da carne. Os produtos já receberam aprovação regulatória para consumo nos EUA e em todo o mundo, embora os custos e a disponibilidade continuem limitados. Acredito que avanços como este nos deixarão muito mais perto de ver carne cultivada a preços acessíveis em nossos supermercados locais nos próximos anos.”
Referência: “A sinalização autócrina projetada elimina os requisitos de FGF2 das células musculares para a produção de carne cultivada” por Andrew J. Stout, Xiaoli Zhang, Sophia M. Letcher, Miriam L. Rittenberg, Michelle Shub, Kristin M. Chai, Maya Kaul e David L. Kaplan , 26 de janeiro de 2024, Cell Reports Sustentabilidade.
DOI: 10.1016/j.crsus.2023.100009
O estudo foi financiado pelo Instituto Nacional de Saúdeo Departamento de Agricultura dos EUA e a New Harvest Foundation.