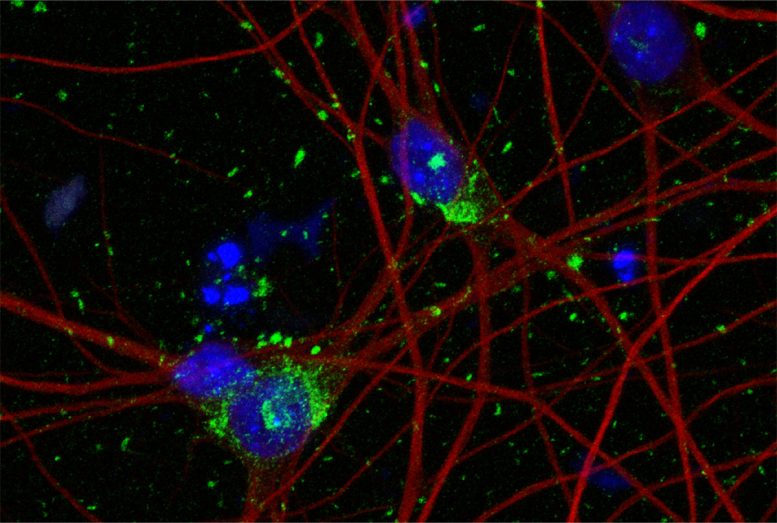
A coloração de neurônios derivados de células-tronco humanas mostra DNA nos núcleos das células (azul), no citoesqueleto dos neurônios (vermelho) e nos agregados de tau (verde). Crédito: Jesus Madero Perez
Cientistas da Weill Cornell Medicine desenvolveram um modelo inovador de neurônios humanos que simula de forma robusta a disseminação de agregados de proteína tau no cérebro – um processo que impulsiona o declínio cognitivo em Alzheimer doença e demência frontotemporal. Este novo modelo levou à identificação de novos alvos terapêuticos que poderiam potencialmente bloquear a propagação da tau.
O estudo pré-clínico, publicado em 5 de abril em Célulaé um avanço significativo na pesquisa da doença de Alzheimer.
“Atualmente, nenhuma terapia pode impedir a propagação de agregados de tau nos cérebros de pacientes com doença de Alzheimer”, disse o principal autor do estudo, Dr. Li Gan, diretor do Instituto de Pesquisa da Doença de Alzheimer Helen e Robert Appel e do Burton P. e Judith B. Resnick Distinguished Professor em Doenças Neurodegenerativas no Feil Family Brain and Mind Research Institute na Weill Cornell Medicine. “Nosso modelo de neurônios humanos de disseminação de tau supera as limitações dos modelos anteriores e revelou alvos potenciais para o desenvolvimento de medicamentos que eram anteriormente desconhecidos.”
Células-tronco pluripotentes humanas podem se desenvolver em qualquer célula do corpo e podem ser induzidas a se tornarem neurônios para modelar doenças cerebrais em uma placa de laboratório. No entanto, tem sido quase impossível modelar a propagação da tau nestes neurônios jovens, uma vez que a propagação da tau requer décadas em cérebros envelhecidos.
Avanços na Modelagem do Tau Spread
A equipe do Dr. Gan usou a tecnologia CRISPR para modificar os genomas das células-tronco humanas, levando-as a expressar formas de tau associadas ao envelhecimento cerebral doente. “Este modelo mudou o jogo, simulando a propagação da tau nos neurônios em semanas – um processo que normalmente levaria décadas no cérebro humano”, disse o Dr.
Em sua busca para interromper a propagação da tau, a equipe do Dr. Gan empregou a triagem CRISPRi para desativar mil genes e determinar seu papel na propagação da tau. Eles descobriram 500 genes que têm um impacto significativo na abundância de tau.
“A tecnologia CRISPRi nos permitiu usar abordagens imparciais para procurar alvos de medicamentos, não se limitando ao que foi relatado anteriormente por outros cientistas”, disse uma das principais autoras do estudo, Celeste Parra Bravo, doutoranda em neurociência na Weill Cornell Graduate School of Medical. Ciências trabalhando no laboratório Gan.
Descobertas e implicações para o tratamento
Uma descoberta inclui a cascata UFMylation, um processo celular que envolve a ligação de uma pequena proteína chamada UFM1 a outras proteínas. A conexão deste processo com a propagação da tau era anteriormente desconhecida. Estudos post-mortem de cérebros de pacientes com doença de Alzheimer descobriram que a UFMylation está alterada, e a equipe também descobriu em modelos pré-clínicos que a inibição da enzima necessária para a UFMylation bloqueia a propagação da tau nos neurônios.
“Estamos particularmente encorajados com a confirmação de que a inibição da UFMylation bloqueou a propagação da tau tanto em neurônios humanos quanto em modelos de camundongos”, disse o coautor do artigo, Dr. Shiaoching Gong, professor associado de pesquisa em neurociência no Instituto Appel da Weill Cornell Medicine.
Muitos tratamentos para a doença de Alzheimer mostram-se inicialmente promissores em modelos de camundongos, mas não têm sucesso em ensaios clínicos, disse o Dr. Gan. Com o novo modelo de célula humana, ela está otimista quanto ao caminho a seguir. “Nossas descobertas em neurônios humanos abrem a porta para o desenvolvimento de novos tratamentos que podem realmente fazer a diferença para aqueles que sofrem desta doença devastadora.”
Referência: “Modelo de tauopatia humana iPSC 4R revela modificadores da propagação de tau” por Celeste Parra Bravo, Alice Maria Giani, Jesus Madero Perez, Zeping Zhao, Yuansong Wan, Avi J. Samelson, Man Ying Wong, Alessandro Evangelisti, Ethan Cordes, Li Fan , Pearly Ye, Daphne Zhu, Tatyana Pozner, Maria Mercedes, Tark Patel, Allan Yarahmady, Gillian K. Carling, Fredrik H. Sterky, Virginia MY Lee, Edward B. Lee, Michael DeTure, Dennis W. Dickson, Manu Sharma, Sue -Ann Mok, Wenjie Luo, Mingrui Zhao, Martin Kampmann, Shiaoching Gong e Li Gan, 5 de abril, Célula.
DOI: 10.1016/j.cell.2024.03.015