Um estudo inovador envolvendo pesquisadores de instituições japonesas revelou os mecanismos genéticos e epigenéticos por trás do transtorno do espectro do autismo, usando um modelo de rato com haploinsuficiência KMT2C. Crédito: SciTechDaily.com
Cientistas japoneses descobrem a base genética do autismo através de um estudo sobre a haploinsuficiência KMT2C em ratos, revelando a promessa terapêutica do vafidemstat no tratamento de sintomas relacionados ao TEA.
O transtorno do espectro do autismo (TEA) abrange condições de neurodesenvolvimento em que os pacientes apresentam comportamento repetitivo e sociabilidade prejudicada. Foi demonstrado que fatores genéticos influenciam o desenvolvimento do TEA. Além disso, estudos recentes mostraram que os genes envolvidos na modificação da cromatina e na transcrição gênica estão envolvidos na patogênese do TEA.
Entre os muitos genes implicados neste processo, o gene KMT2C (lisina metiltransferase 2c), que codifica uma unidade catalítica do complexo metiltransferase H3K4 (histona H3 lisina 4), foi identificado como associado ao desenvolvimento de autismo e outros distúrbios do neurodesenvolvimento. Estudos anteriores demonstraram que a haploinsuficiência (uma condição em que, das duas cópias do gene, apenas uma permanece funcional) de KMT2C é um fator de risco para TEA e outros transtornos do neurodesenvolvimento. No entanto, o mecanismo molecular através do qual a mutação de perda de função em KMT2C leva a essas condições permanece obscuro.
Pesquisa pioneira no Japão
Para colmatar esta lacuna de conhecimento, investigadores da Universidade Juntendo, RIKEN, e da Universidade de Tóquio, no Japão, procuraram fornecer respostas a estas questões num estudo de referência publicado na revista Psiquiatria Molecular em 26 de março de 2024. A equipe de pesquisa incluiu o professor Tadafumi Kato do Departamento de Psiquiatria e Ciências do Comportamento da Escola de Pós-Graduação em Medicina da Universidade Juntendo, o Dr. da Escola de Pós-Graduação em Artes e Ciências da Universidade de Tóquio.
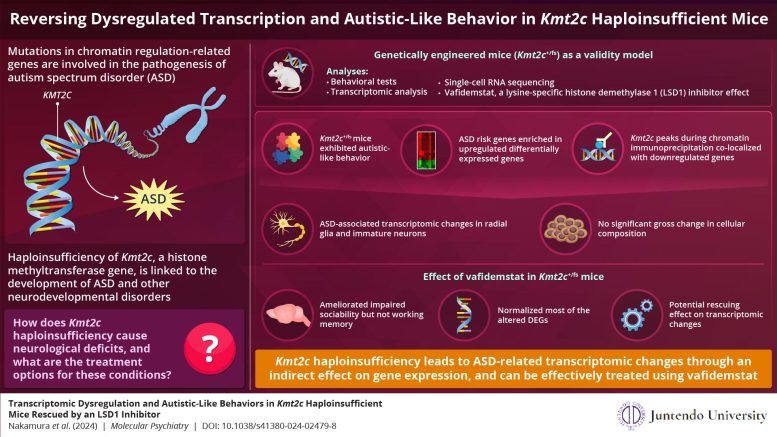
Os genes envolvidos na modificação da cromatina e na transcrição gênica estão associados à progressão de distúrbios do neurodesenvolvimento. Pesquisadores do Japão desenvolveram um novo modelo de camundongo para estudar o mecanismo molecular por trás da capacidade do KMT2C de causar transtorno do espectro do autismo. Eles também mostraram que o vafidemstat tem um efeito salvador ao normalizar a expressão genética interrompida. Crédito: Tadafumi Kato da Universidade Juntendo, Japão
Para chegar ao fundo KMT2CPara avaliar o papel do ASD na patogênese do TEA, a equipe desenvolveu e analisou cepas de camundongos geneticamente modificados (Kmt2c+/fs) tendo uma mutação frameshift que modela o KMT2C haploinsuficiência. Eles então realizaram várias análises comportamentais, nas quais observaram que os camundongos mutantes exibiam menor sociabilidade, inflexibilidade, hipersensibilidade auditiva e deficiências cognitivas, todos sintomas relacionados ao TEA.
Insights genéticos e epigenéticos
Em seguida, eles realizaram perfis transcriptômicos e epigenéticos para compreender a base das alterações moleculares observadas nos camundongos mutantes. O que descobriram foi notável: os genes associados ao risco aumentado de ASD mostraram maior expressão nestes ratos mutantes. O Dr. Takata exclama: “Isso foi um tanto inesperado. O KMT2C medeia a metilação do H3K4, que se acredita ativar a expressão genética e, portanto, esperava-se que a haploinsuficiência do KMT2C causasse a redução da expressão dos genes alvo.
Para obter informações mecanicistas sobre a sua descoberta, os investigadores realizaram a imunoprecipitação da cromatina, uma técnica para determinar a localização no ADN onde a proteína interage com ela. Eles encontraram uma sobreposição entre KMT2C e os genes expressos diferencialmente exibindo expressão reduzida, sugerindo que KMT2C a haploinsuficiência leva a alterações transcriptômicas relacionadas ao TEA por meio de um efeito indireto na expressão gênica.
Além disso, para identificar os tipos de células que mais contribuem para as alterações patológicas observadas nos camundongos mutantes, os pesquisadores realizaram testes unicelulares. ARN sequenciamento de cérebros de ratos recém-nascidos. Eles observaram que os genes alterados associados ao risco de TEA eram predominantes em células gliais radiais indiferenciadas. No entanto, não foi observada uma alteração grosseira na composição celular, implicando que a desregulação transcriptómica não tem impacto grave no destino celular.
Potencial terapêutico do Vafidemstat
Finalmente, os pesquisadores testaram os efeitos do vafidemstat, um inibidor penetrante cerebral do LSD1 (histona desmetilase 1A específica da lisina), que poderia melhorar as anormalidades de metilação das histonas. Eles descobriram que o vafidemstat melhorou os déficits sociais nos camundongos mutantes e teve um efeito de resgate excepcional, alterando os níveis de expressão dos genes expressos diferencialmente para o seu nível de expressão normal. Esta descoberta mostrou que o vafidemstat é um medicamento válido para camundongos mutantes e pode potencialmente ajudar a restaurar o estado transcriptômico normal.
O que diferencia esta descoberta é que ela desafia a crença comum de que a deficiência do TEA pode não ser curada e demonstra a eficácia do vafidemstat na melhoria dos fenótipos semelhantes aos do TEA. Os resultados abrem portas para pesquisas futuras para fortalecer as bases para o tratamento farmacológico do TEA e de outros transtornos do neurodesenvolvimento. O professor Kato conclui: “Nossa pesquisa mostra que medicamentos semelhantes ao vafidemstat podem ser generalizáveis para múltiplas categorias de transtornos psiquiátricos”.
Referência: “Desregulação transcriptômica e comportamentos semelhantes aos do autismo em camundongos haploinsuficientes Kmt2c resgatados por um inibidor de LSD1” por Takumi Nakamura, Toru Yoshihara, Chiharu Tanegashima, Mitsutaka Kadota, Yuki Kobayashi, Kurara Honda, Mizuho Ishiwata, Junko Ueda, Tomonori Hara, Moe Nakanishi , Toru Takumi, Shigeyoshi Itohara, Shigehiro Kuraku, Masahide Asano, Takaoki Kasahara, Kazuo Nakajima, Takashi Tsuboi, Atsushi Takata e Tadafumi Kato, 26 de março de 2024, Psiquiatria Molecular.
DOI: 10.1038/s41380-024-02479-8