
Um novo estudo revela que na doença de Alzheimer, um fragmento da proteína precursora da amiloide (APP-CTF) perturba processos celulares essenciais, podendo causar a morte precoce dos neurónios. Esta descoberta sugere que os tratamentos da DA devem concentrar-se na prevenção da acumulação de APP-CTF.
Os APP-CTFs interferem na comunicação entre organelas, perturbando o equilíbrio celular.
Alzheimer A doença (DA) continua a ser uma condição neurodegenerativa significativa e generalizada, afetando milhões de pessoas em todo o mundo. Num estudo recentemente publicado em Célula de Desenvolvimentopesquisadores do laboratório de Wim Annaert (VIB-KU Leuven) identificaram um novo mecanismo potencialmente ligado aos estágios iniciais da DA.
Eles demonstraram que um fragmento da proteína precursora de amilóide (APP), chamada APP-CTF, interrompe a comunicação entre compartimentos celulares cruciais para o armazenamento de cálcio e eliminação de resíduos, o que poderia ser um evento precoce que precede a morte celular neuronal. Estas descobertas, com potenciais implicações para o desenvolvimento de novos tratamentos para a DA, sugerem que a prevenção da acumulação de APP-CTF deve ser tida em conta para desenvolver tratamentos mais eficazes.
A doença de Alzheimer é caracterizada pela perda progressiva da função cognitiva, comprometimento da memória e alterações comportamentais. Uma das características visíveis no cérebro das pessoas com doença de Alzheimer é a formação de placas amilóides – aglomerados de péptidos β-amilóide (Aβ), que são produtos degradados da proteína precursora amilóide (APP). Esses fragmentos Aβ se acumulam nos neurônios no início da doença, mesmo antes de o declínio cognitivo ser observado.
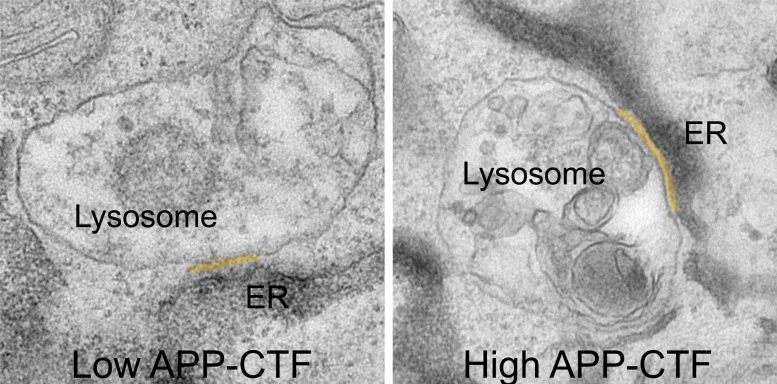
Fragmentos APP-C-Terminal (APP-CTFs) acumulam-se entre o retículo endoplasmático e os lisossomas. Crédito: VIB
Novas pesquisas, no entanto, sugerem que pode haver eventos anteriores acontecendo no cérebro com DA antes da formação da placa e que a proteína APP desempenha um papel nesses estágios iniciais. O mecanismo por trás disso permaneceu um mistério até agora.
No seu último estudo, o laboratório de Wim Annaert no VIB-KU Leuven Centre for Brain & Disease Research identificou um mecanismo que explica como a APP pode contribuir para estas fases iniciais da DA. Esta descoberta pode levar a uma nova direção na pesquisa e nas abordagens de tratamento da DA.
Interrompendo a comunicação celular
A APP é encontrada nas membranas celulares das células cerebrais. O cérebro produz constantemente novas moléculas de APP enquanto decompõe e remove as antigas. Esse processo envolve tesouras enzimáticas, sendo a gama-secretase a última que gera os conhecidos e bem estudados peptídeos Aβ na DA.
Durante muito tempo, pensou-se que o bloqueio da gama-secretase seria o passo lógico para prevenir a produção de fragmentos Aβ tóxicos. No entanto, isto leva à acumulação do seu precursor, os Fragmentos APP-C-Terminal, ou APP-CTFs. Agora, os pesquisadores descobriram que esses fragmentos também são tóxicos para os neurônios. Eles parecem acumular-se entre o retículo endoplasmático (RE), o compartimento que é crucial para a síntese lipídica e o armazenamento de cálcio, e os lisossomos, os chamados “caixotes de lixo” dos neurônios, que são críticos para a degradação dos resíduos da célula.
“Ao fazer isso, os APP-CTFs perturbam o delicado equilíbrio do cálcio nos lisossomas”, explica a Dra. Marine Bretou, primeira autora do estudo. “Essa interrupção desencadeia uma cascata de eventos. O RE já não consegue reabastecer eficazmente os lisossomas com cálcio, levando a uma acumulação de colesterol e a um declínio na sua capacidade de decompor os resíduos celulares. Isto resulta no colapso de todo o sistema endolisossomal, um caminho crucial para manter os neurônios saudáveis.”
O novo estudo apoia ainda que os APP-CTFs resultantes da supressão da gama-secretase podem, na verdade, ser os culpados pela disfunção endolisossomal, como observado nos estágios iniciais da DA.
Uma mudança de paradigma na compreensão dos estágios iniciais da patogênese da DA
Esta pesquisa avança significativamente a nossa compreensão das causas potenciais da doença nos estágios iniciais da DA. Um resultado notável deste estudo é que estes estágios iniciais podem ser causados por outro fragmento da mesma molécula de APP e não por Aβ. Isto tem implicações significativas para as abordagens terapêuticas atuais que visam limpar o cérebro com DA das placas amilóides, uma vez que tendem a ignorar os efeitos tóxicos de outros fragmentos. Outras tentativas concentram-se nas proteínas tau ou na neuroinflamação, que são outras marcas da progressão da DA que visam eventos posteriores. No entanto, a intervenção precoce é provavelmente a chave para parar ou mesmo prevenir a DA.
“O fracasso dos ensaios clínicos utilizando inibidores da gama-secretase pode ser explicado pelo facto de nos concentrarmos num único culpado e numa fase demasiado avançada da doença”, explica o Prof. Wim Annaert, autor principal do estudo. “Os resultados da nossa investigação sugerem que os moduladores da gama-secretase, que podem ajudar a promover a eliminação de APP-CTFs tóxicos sem bloquear completamente a enzima, podem ser um alvo mais relevante para a intervenção precoce na DA. A chave pode ser encontrar o equilíbrio certo entre a eliminação de APP-CTF e a prevenção de placas.”
Olhando para o futuro, os cientistas estão a unir esforços com colegas para desenvolver estes moduladores com base nestas novas descobertas e continuarão a explorar a homeostase celular nas fases iniciais da DA.
Referência: “O acúmulo de fragmentos C-terminais de APP causa disfunção endolisossomal através da desregulação do endossomo tardio para locais de contato lisossomo-ER” por Marine Bretou, Ragna Sannerud, Abril Escamilla-Ayala, Tom Leroy, Céline Vrancx, Zoë P. Van Acker, Anika Perdok, Wendy Vermeire, Inge Vorsters, Sophie Van Keymolen, Michelle Maxson, Benjamin Pavie, Keimpe Wierda, Eeva-Liisa Eskelinen e Wim Annaert, 15 de abril de 2024, Célula de Desenvolvimento.
DOI: 10.1016/j.devcel.2024.03.030
A pesquisa foi financiada pela Fondation Recherche Alzheimer – Stichting Alzheimer Onderzoek (STOPALZHEIMER.BE), pela Associação de Alzheimer e pelo Programa FWO.