Os investigadores estão a investigar bacteriófagos, particularmente fagos “jumbo” com genomas grandes, como ferramentas potenciais para combater bactérias resistentes a antibióticos. Esses fagos podem ser projetados para fornecer antibióticos diretamente às infecções, oferecendo uma nova estratégia na luta contra patógenos mortais.
No início do século 20, os antibióticos ganharam amplo reconhecimento como um tratamento eficaz para infecções bacterianas. Naquela que é considerada a era de ouro dos antibióticos, eles foram desenvolvidos regularmente ao longo de meados do século XX. Contudo, esta era de ouro não durou.
À medida que os antibióticos foram prescritos com mais frequência, as bactérias evoluíram. Eles ficaram mais bem equipados para derrotar os antibióticos, tornando muitos inúteis. A queda acentuada na eficácia dos antibióticos continuou e resultou na atual crise de resistência aos antibióticos.
Potencial terapêutico de fagos jumbo
Os cientistas recorrem agora a um aliado invulgar, os vírus, para ajudar a combater esta ameaça crescente. Recentemente, os investigadores concentraram-se nos vírus conhecidos como bacteriófagos como uma nova ferramenta para tratar e desarmar bactérias resistentes a antibióticos. Foi dada especial atenção aos fagos “jumbo” – vírus recentemente descobertos com genomas extremamente grandes – que poderiam ser aproveitados como agentes de distribuição especiais que podem não só matar bactérias, mas também podem ser concebidos para fornecer antibióticos diretamente à fonte de infecção.
Mas, para fornecer novas terapêuticas através dos fagos, os cientistas devem primeiro compreender a extraordinária composição biológica e os mecanismos dentro destes vírus misteriosos.
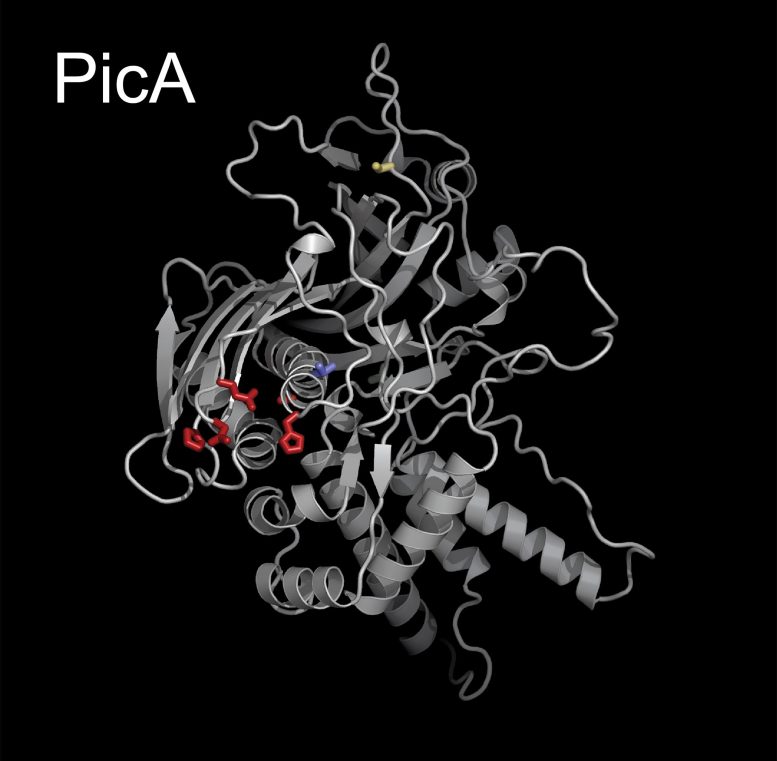
Uma imagem gráfica do PicA, um componente-chave do fago gigante que coordena o tráfego de proteínas através da camada protetora do núcleo do fago. Crédito: Pogliano Labs, UC San Diego
Pesquisa e descobertas
Pesquisadores da Escola de Ciências Biológicas da Universidade da Califórnia em San Diego e seus colegas do Innovative Genomics Institute da UC Berkeley e da Universidade Chulalongkorn em Bangkok deram um passo substancial na decifração de várias funções-chave dentro dos fagos jumbo.
“Esses fagos gigantes têm genomas grandes que, em teoria, poderiam ser manipulados para transportar cargas úteis que matam bactérias de maneira mais eficaz”, disse Joe Pogliano, professor da Escola de Ciências Biológicas da UC San Diego e autor sênior do novo artigo, que foi publicado recentemente. no Anais da Academia Nacional de Ciências. “O problema é que o genoma deles está fechado e não é de fácil acesso. Mas agora descobrimos alguns dos seus elementos-chave.”
Conforme descrito no artigo, a pesquisa liderada pelo estudante de pós-graduação da Escola de Ciências Biológicas Chase Morgan concentrou-se em fagos enormes de Chimalliviridae que se replicaram dentro de bactérias, formando um compartimento que se assemelha ao núcleo dentro das células de humanos e outros organismos vivos. O compartimento semelhante ao núcleo do Chimalliviridae separa e importa seletivamente certas proteínas que permitem sua replicação dentro da bactéria hospedeira. Mas como o desenrolar deste processo foi uma parte intrigante do processo.

O vírus jumbo phikzvirus, ou phiKZ, é conhecido por infectar bactérias Pseudomonas. Crédito: Pogliano Labs, UC San Diego
Usando novas ferramentas genéticas e de biologia celular, Morgan e seus colegas identificaram uma proteína-chave, que chamaram de “importador de proteína do Chimallivírus A”, ou PicA, que atua como uma espécie de segurança de boate, traficando proteínas seletivamente, garantindo a entrada dentro do núcleo para alguns, mas negando acesso a outros. Eles descobriram que o PicA coordena o tráfego de proteínas de carga através da camada protetora do núcleo do fago.
“Só o fato de que isso vírus é capaz de montar essa estrutura e sistema de transporte incrivelmente complexos é realmente incrível e como nunca vimos antes”, disse Morgan. “O que consideramos biologia complexa é geralmente reservado para formas de vida superiores como os humanos e as nossas dezenas de milhares de genes, mas aqui estamos a ver processos funcionalmente análogos num genoma viral comparativamente pequeno de apenas aproximadamente 300 genes. É provavelmente o sistema de transporte seletivo mais simples que conhecemos.”
Usando CRISPRi-ART, um programa programável ARN ferramenta para estudar genomas, os pesquisadores conseguiram demonstrar que o PicA é um componente essencial do processo de desenvolvimento e replicação do núcleo dos Chimalliviridae.
“Sem a simplicidade e versatilidade das tecnologias CRISPR direcionadas ao RNA, seria quase impossível fazer e responder diretamente a essas perguntas. Estamos realmente entusiasmados em ver como essas ferramentas desvendam os mistérios codificados pelos genomas dos fagos”, disse o coautor Ben Adler, pesquisador de pós-doutorado que trabalha com Jennifer Doudna, pioneira do CRISPR ganhadora do Prêmio Nobel.

Alunos de pós-graduação da Escola de Ciências Biológicas Chase Morgan e Emily Armbruster, coautores do artigo PNAS. Crédito: Pogliano Labs, UC San Diego
Implicações para a terapia fágica
As bactérias e os vírus têm-se envolvido numa espécie de corrida armamentista durante milhares de milhões de anos, cada um evoluindo para contrariar as adaptações do outro. Os pesquisadores dizem que o sofisticado sistema de transporte PicA é resultado dessa intensa e contínua competição evolutiva. O sistema evoluiu para ser altamente flexível e altamente seletivo, permitindo apenas os principais elementos benéficos dentro do núcleo. Sem o sistema PicA, as proteínas defensivas da bactéria entrariam e sabotariam o processo de replicação do vírus.
Essas informações são vitais à medida que os cientistas da Emerging Pathogens Initiative, financiada pelo Howard Hughes Medical Institute (HHMI), e do Center for Innovative Phage Applications and Therapeutics da UC San Diego se esforçam para estabelecer as bases para eventualmente programar geneticamente fagos para tratar uma variedade de doenças mortais.
“Nós realmente não tínhamos qualquer compreensão de como funcionava o sistema de importação de proteínas ou quais proteínas estavam envolvidas anteriormente, então esta pesquisa é o primeiro passo para a compreensão de um processo chave que é crítico para que esses fagos se repliquem com sucesso”, disse a Escola de Ciências Biológicas. a estudante de pós-graduação Emily Armbruster, coautora do artigo. “Quanto mais compreendermos estes sistemas essenciais, melhor seremos capazes de projetar fagos para uso terapêutico.
Os alvos futuros para esses vírus geneticamente programados incluem Pseudomonas aeruginosa bactérias, que são conhecidas por causar infecções potencialmente fatais e representar riscos para pacientes em hospitais. Outros alvos promissores incluem E. coli e Klebsiella, que podem causar infecções crónicas e recorrentes e, em alguns casos, entrar na corrente sanguínea, o que pode ser fatal.
Referência: “Uma via de importação de proteína essencial e altamente seletiva codificada por fago formador de núcleo” por Chase J. Morgan, Eray Enustun, Emily G. Armbruster, Erica A. Birkholz, Amy Prichard, Taylor Forman, Ann Aindow, Wichanan Wannasrichan, Sela Peters, Koe Inlow, Isabelle L. Shepherd, Alma Razavilar, Vorrapon Chaikeeratisak, Benjamin A. Adler, Brady F. Cress, Jennifer A. Doudna, Kit Pogliano, Elizabeth Villa, Kevin D. Corbett e Joe Pogliano, 30 de abril de 2024, Anais da Academia Nacional de Ciências.
DOI: 10.1073/pnas.2321190121