Os investigadores identificaram um novo mecanismo pelo qual o ADN mitocondrial (mtDNA) mal colocado pode causar inflamação, oferecendo alvos potenciais para intervenção terapêutica contra doenças autoimunes e inflamações relacionadas com o envelhecimento. Crédito: SciTechDaily.com
Os cientistas da Salk descrevem o caminho da inflamação das células do rato, desde o estresse mitocondrial até o vazamento de endossomos e a iniciação do sistema imunológico, revelando novos alvos terapêuticos potenciais para reduzir a inflamação no envelhecimento e nas doenças.
As células do corpo humano contêm mitocôndrias geradoras de energia, cada uma com seu próprio mtDNA – um conjunto único de instruções genéticas totalmente separadas do núcleo nuclear da célula. ADN que as mitocôndrias usam para criar energia vital. Quando o mtDNA permanece onde pertence (dentro das mitocôndrias), ele sustenta a saúde mitocondrial e celular – mas quando vai para onde deve não pertencem, pode iniciar uma resposta imunológica que promove inflamação.
Descoberta do mecanismo de extravio de mtDNA
Agora, os cientistas da Salk e colaboradores da UC San Diego descobriram um novo mecanismo usado para remover o mtDNA que funciona incorretamente de dentro para fora das mitocôndrias. Quando isso acontece, o mtDNA é sinalizado como DNA estranho e ativa uma via celular normalmente usada para promover inflamação para livrar a célula de patógenos, como vírus.
As descobertas, publicadas em Biologia Celular da Natureza hoje (8 de fevereiro de 2024), oferecem muitos novos alvos terapêuticos para interromper a via inflamatória e, portanto, mitigar a inflamação durante o envelhecimento e doenças, como lúpus ou artrite reumatóide.
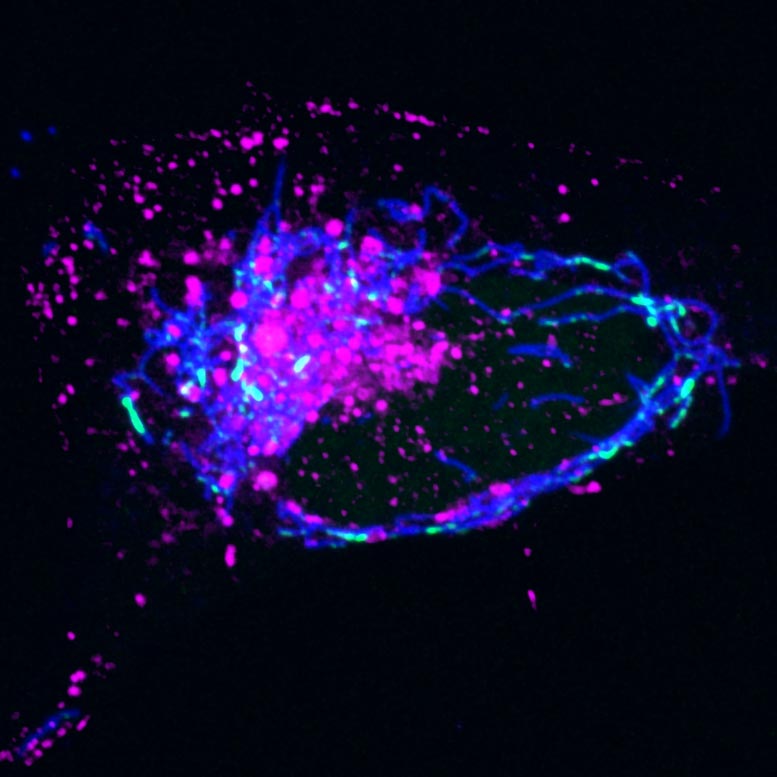
Os endossomos (magenta) se acumulam ao redor das mitocôndrias (azul) após a infecção pelo vírus HSV-1, que ataca o mtDNA (verde) e causa sua liberação. Crédito: Instituto Salk
Mecanismo e implicações terapêuticas
“Sabíamos que o mtDNA estava escapando das mitocôndrias, mas como ainda não estava claro”, diz o autor sênior e co-correspondente, Professor Gerald Shadel, diretor do Centro de Excelência em Biologia Básica do Envelhecimento de San Diego-Nathan Shock e titular da Cátedra Audrey Geisel em Ciências Biomédicas em Salk. “Usando abordagens de imagem e biologia celular, somos capazes de traçar as etapas do caminho para mover o mtDNA para fora das mitocôndrias, que agora podemos tentar atingir com intervenções terapêuticas para evitar a inflamação resultante.”
Uma das maneiras pelas quais nossas células respondem a danos e infecções é por meio do que é conhecido como sistema imunológico inato. Embora a resposta imune inata seja a primeira linha de defesa contra vírus, ela também pode responder a moléculas que o corpo produz que simplesmente se assemelham a patógenos – incluindo o mtDNA mal colocado. Esta resposta pode levar à inflamação crónica e contribuir para doenças humanas e envelhecimento.

A partir da esquerda: Gerald Shadel, Laura Newman e Uri Manor. Crédito: Instituto Salk
Os cientistas têm trabalhado para descobrir como o mtDNA deixa as mitocôndrias e desencadeia a resposta imunitária inata, mas as vias anteriormente caracterizadas não se aplicavam às condições únicas de stress do mtDNA que a equipa de Salk estava a investigar. Então, eles recorreram a técnicas sofisticadas de imagem para reunir pistas sobre onde e quando as coisas estavam dando errado nessas mitocôndrias.
Novos insights e direções futuras
“Tivemos um grande avanço quando vimos que o mtDNA estava dentro de uma misteriosa estrutura de membrana assim que saiu da mitocôndria – depois de montar todas as peças do quebra-cabeça, percebemos que a estrutura era um endossomo”, diz a primeira autora Laura Newman, ex-pesquisadora de pós-doutorado em Laboratório de Shadel e atual professor assistente na Universidade da Virgínia. “Essa descoberta eventualmente nos levou à conclusão de que o mtDNA estava sendo descartado e, no processo, parte dele estava vazando.”
A equipe descobriu um processo que começa com um mau funcionamento na replicação do mtDNA que faz com que massas de proteínas contendo mtDNA, chamadas nucleóides, se acumulem dentro das mitocôndrias. Percebendo esse mau funcionamento, a célula começa então a remover os nucleóides que interrompem a replicação, transportando-os para endossomas, uma coleção de organelas que classificam e enviam material celular para remoção permanente. O endossomo fica sobrecarregado com esses nucleóides, ocorre um vazamento e o mtDNA fica subitamente solto na célula. A célula sinaliza esse mtDNA como DNA estranho – da mesma forma que sinaliza um vírus‘s DNA – e inicia a via cGAS-STING com detecção de DNA para causar inflamação.
“Usando nossas ferramentas de imagem de ponta para sondar a dinâmica das mitocôndrias e a liberação de mtDNA, descobrimos um mecanismo de liberação inteiramente novo para o mtDNA”, diz o co-autor Uri Manor, ex-diretor do Waitt Advanced Biophotonics Core em Salk e atual professor assistente. na Universidade da Califórnia em San Diego. “Há tantas perguntas de acompanhamento que mal podemos esperar para perguntar, como como outras interações entre organelas controlam as vias imunológicas inatas, como diferentes tipos de células liberam mtDNA e como podemos direcionar essa nova via para reduzir a inflamação durante doenças e envelhecimento”.
Os investigadores esperam mapear mais desta complicada via de eliminação do mtDNA e de activação imunitária, incluindo quais as circunstâncias biológicas – como a disfunção da replicação do mtDNA e a infecção viral – são necessárias para iniciar a via e quais os efeitos a jusante que podem haver na saúde humana. Eles também veem uma oportunidade para inovação terapêutica utilizando esta via, que representa um novo alvo celular para reduzir a inflamação.
Referência: “O estresse de replicação do DNA mitocondrial ativa uma via endossomal de eliminação de nucleóides propensa à ativação do sistema imunológico inato” 8 de fevereiro de 2024, Biologia Celular da Natureza.
DOI: 10.1038/s41556-023-01343-1
Outros autores incluem Sammy Weiser Novak, Gladys Rojas, Nimesha Tadepalle, Cara Schiavon, Christina Towers, Matthew Donnelly, Sagnika Ghosh, Sienna Rocha e Ricardo Rodriguez-Enriquez de Salk; Danielle Grotjahn e Michaela Medina do Scripps Research Institute; Marie-Ève Tremblay, da Universidade de Victoria, no Canadá; Joshua Chevez, da Universidade da Califórnia em San Diego; e Ian Lemersal do Instituto La Jolla de Imunologia.
O trabalho contou com o apoio do Instituto Nacional de Saúde (R01 AR069876, P30AG068635, 1K99GM141482, 1F32GM137580, T32GM007198, 5R00CA245187 e 5R00CA245187-04S1), um prêmio da Iniciativa Allen-AHA em Saúde Cerebral e Deficiência Cognitiva (19PABH134610000 H), um prêmio NeuroNex da National Science Foundation (2014862), Iniciativa Chan-Zuckerberg Prêmio Cientista de Imagem, Fundação LIFE, Bolsa de Pós-Doutorado da Fundação George E. Hewitt para Pesquisa Médica, Bolsa de Pós-Doutorado da Fundação Paul F. Glenn para Pesquisa Médica, Prêmio Acadêmico de Pós-Doutorado do Salk Pioneer Fund, Fundação Waitt, Universidade de Yale Centro de Imagem Celular e Molecular da Escola de Medicina, Cátedra de Pesquisa do Canadá (Nível 2) em Neurobiologia do Envelhecimento e Cogniçãoe um Fundo de Líderes da Fundação Canadense para Inovação John R. Evans (concessão 39965).